El calor específico puede deducirse de la ecuación:
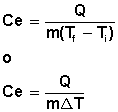
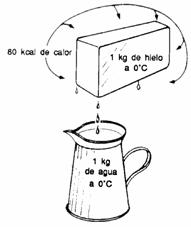 |
| Si a 1 kg de hielo (a 0º C) le aplicamos 80 kcal obtendremos 1 kg de agua a 0º C. |
Calor latente de fusión
Para que un sólido pase al estado líquido debe absorber la energía necesaria a fin de destruir las uniones entre sus moléculas. Por lo tanto, mientras dura la fusión no aumenta la temperatura. Por ejemplo, para fundir el hielo o congelar el agua sin cambio en la temperatura, se requiere un intercambio de 80 calorías por gramo, o 80 kilocalorías por kilogramo.
El calor requerido para este cambio en el estado físico del agua sin que exista variación en la temperatura recibe el nombre de calor latente de fusión o simplemente calor de fusión del agua.
Esto significa que si sacamos de un congelador cuya temperatura es de –6° C un pedazo de hielo de masa igual a 100 gramos y lo ponemos a la intemperie, el calor existente en el ambiente elevará la temperatura del hielo, y al llegar a 0° C y seguir recibiendo calor se comenzará a fundir.
A partir de ese momento todo el calor recibido servirá para que la masa de hielo se transforme en agua líquida. Como requiere de 80 calorías por cada gramo (ver cuadro), necesitará recibir 8.000 calorías del ambiente para fundirse completamente. Cuando esto suceda, el agua se encontrará aún a 0° C y su temperatura se incrementará sólo si se continúa recibiendo calor, hasta igualar su temperatura con el ambiente.
Calor de fusión de cada sustancia
El calor de fusión es una propiedad característica de cada sustancia, pues según el material de que esté hecho el sólido requerirá cierta cantidad de calor para fundirse. Por definición: el calor latente de fusión de una sustancia es la cantidad de calor que requiera ésta para cambiar 1 gramo de sólido a 1 gramo de líquido sin variar su temperatura.
Los cálculos pertinentes se realizan utilizando las fórmulas:
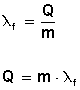
Donde λf = calor latente de fusión en cal/gramo.
Q = calor suministrado en calorías.
m = masa de la sustancia en gramos.
En el cuadro siguiente se dan algunos valores del calor latente de fusión para diferentes sustancias.
Sustancia λf en cal/gr.
Agua 80
Hierro 6
Cobre 42
Plata 21
Platino 27
Oro 16
Mercurio 2,8
Plomo 5,9
Agua 80
Hierro 6
Cobre 42
Plata 21
Platino 27
Oro 16
Mercurio 2,8
Plomo 5,9
No hay comentarios:
Publicar un comentario