Es el estado en el que se igualan las temperaturas de dos cuerpos que inicialmente tenían diferentes temperaturas. Al igualarse las temperaturas se suspende el flujo de calor, y el sistema formados por esos cuerpos llega a su equilibrio térmico.
Por ejemplo, si pone tienes un recipiente con agua caliente, y otro con agua fría, a través de sus paredes se establecera un flujo de energía calorífica, pasado un tiempo, la temperatura del agua en ambos recipientes se igualará (por obra de las tranferencias de calor, en este caso del agua más caliente a la más fría, también por contacto con el aire del medio ambiente y por evaporación), pero el equilibrio térmico lo alcanzarán cuando ambas masas de agua estén a la misma temperatura.
La cantidad de calor (Q) que gana o pierde un cuerpo de masa (m) se encuentra con la fórmula
Donde:
Q es la cantidad de calor (que se gana o se pierde), expresada en calorías.
m es la masa del cuerpo en estudio. Se expresa en gramos
Ce es el calor específico del cuerpo. Su valor se encuentra en tablas conocidas. Se expresa en cal / gr º C
Δt es la variación de temperatura = Tf − T0. Léase Temperatura final (Tf) menos Temperatura inicial (T0), y su fórmula es
Hasta aquí hemos hablado siempre de igualar temperaturas y ello nos lleva a concluir que a los cuerpos no se les puede asignar una cantidad de calor. Lo que realmente tiene sentido son los intercambios de calor que se deben a las diferencias de temperaturas que existen entre los cuerpos que están en contacto.
A continuación, desarrollemos algunos ejercicios que nos ayudarán a comprender la materia expuesta:
Ejercicio 1)
¿Cuál será la temperatura de una mezcla de 50 gramos de agua a 20 grados Celsius y 50 gramos de agua a 40 grados Celsius?
Desarrollo:
Datos:
Capacidad calorífica específica del agua: 1 cal/grº C
El agua que está a 20º C ganará temperatura
El agua que está a 40º C perderá temperatura
Sabemos que para conseguir el equilibrio térmico (igualar las temperaturas) la cantidad de calor ganada por un cuerpo debe ser igual a la cantidad de calor perdida por el otro.
Entonces:
para los 50 gr de agua a 20º C tendremos Q1 (cantidad de calor ganada)
reemplazamos los valores y queda
para los 50 gr de agua a 40º C tendremos Q2 (cantidad de calor perdida)
Como Q1 = Q2 (calor ganado = calor perdido)
Entonces:
Respuesta: La temperatura de equilibrio es 30 grados Celcius
Ejercicio2)
¿Cuál será la temperatura final de una mezcla de 100 gramos de agua a 25 grados Celsius con 75 gramos de agua a 40 grados Celsius?
Desarrollo:
Datos:
Capacidad calorífica específica del agua: 1 cal/grº C
Los 100 gr de agua que están a 25º C ganarán temperatura
Los 75 gr de agua que están a 40º C perderán temperatura
Sabemos que Q1 = Q2 (calor ganado = calor perdido)
Entonces
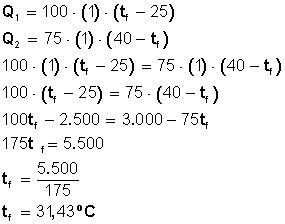
Respuesta: La temperatura final o de equilibrio de la mezcla es 31,43º C.
Ejercicio 3)
¿Cuál será la temperatura final de 50 gramos de agua a 20 grados Celsius cuando se sumergen en ella 110 gramos de clavos de acero a 40 grados Celsius?
Desarrollo:
Datos:
Capacidad calorífica específica del agua: 1 cal/grº C
Capacidad calorífica específica del acero: 0,12 cal/grº C
Los 110 gr de clavos que están a 40º C perderán temperatura
Sabemos que Q1 = Q2 (calor ganado = calor perdido)
Entonces
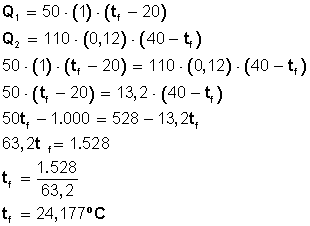
Respuesta: La temperatura final o de equilibrio de los clavos en el agua será de 24,177º C.
Ejercicio 4)
En 300 gramos de agua a 180 grados centígrados se introducen 250 gramos de hierro a 200 grados centígrados, determinar la temperatura de equilibrio.
Desarrollo:
Datos:
Capacidad calorífica específica del agua: 1 cal/grº C
Capacidad calorífica específica del hierro: 0,113 cal/grº C
Los 300 gr de agua que están a 180º C ganarán temperatura
Los 250 gr de hierro que están a 200º C perderán temperatura
Sabemos que Q1 = Q2 (calor ganado = calor perdido)
Entonces
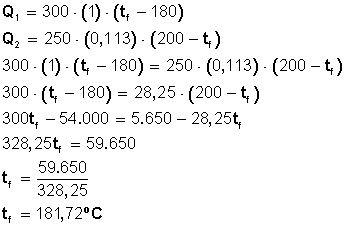
Respuesta: El agua y el hierro sumergido en ésta quedarán a 181,72º C.

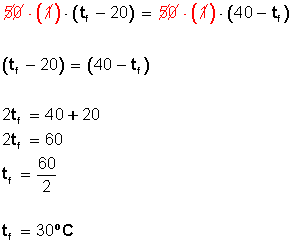

No hay comentarios:
Publicar un comentario